全球首个!又一“成都造”创新药上市申请获受理
近日,记者从国家药品监督管理局药品审评中心(CDE)官网获悉,由四川百利天恒药业股份有限公司(以下简称“百利天恒”)自主研发、全球首创(First-in-class)、新概念(New concept)且唯一进入Ⅲ期临床阶段EGFR x HER3双抗ADC药物 iza-bren(BL-B01D1) 的上市许可申请,成功获得国家药品监督管理局药品审评中心(CDE)受理。
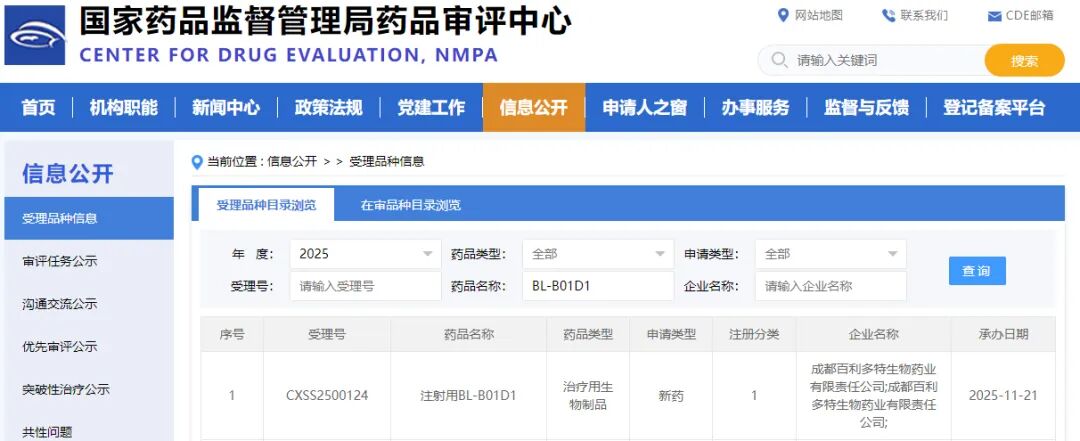
这是iza-bren(BL-B01D1)的首个适应症上市申请获成功受理,也是全球首个靶向EGFRxHER3双特异性抗体偶联药物的新药上市申请成功受理。
此次新药上市申请的成功受理,是基于iza-bren(BL-B01D1)在鼻咽癌的Ⅲ期临床试验(研究方案编号:BL-B01D1-303)期中分析达到主要终点。研究结果显示,iza-bren在治疗既往经PD-1/PD-L1单抗治疗且经至少两线化疗(至少一线含铂)治疗失败的复发性或转移性鼻咽癌中,显示了令人振奋的疗效。
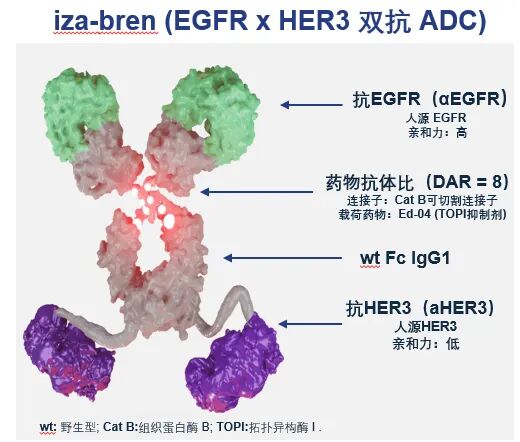
今年9月5日,iza-bren被国家药品监督管理局药品审评中心正式纳入优先审评审批,适用于既往经 PD-1/PD-L1 单抗治疗且经至少两线化疗(至少一线含铂)治疗失败的复发性或转移性鼻咽癌患者。截至目前,iza-bren已获得国家药品监督管理局药品审评中心的7项突破性疗法认定,和美国食品药品管理局(FDA)的1项突破性疗法认定。

iza-bren (BL-B01D1)是全球首创(First-in-class)、新概念(New concept)且唯一进入Ⅲ期临床试验阶段的EGFR×HER3双抗 ADC。百利天恒正在中国和美国就iza-bren(BL-B01D1)开展近40项针对多种肿瘤类型的临床试验,其中,于中国正在开展10项不同癌种的Ⅲ期临床注册研究,于美国正在和战略合作伙伴百时美施贵宝公司共同开展一线晚期三阴性乳腺癌的II/Ⅲ期临床试验、EGFR-TKI耐药后晚期非小细胞肺癌的II/Ⅲ期临床试验和经治晚期转移性尿路上皮癌的II/Ⅲ 期临床试验,以及针对非小细胞肺癌、晚期实体瘤等多项I/Ⅱ期临床试验。


 川公网安备 51019002008035号
川公网安备 51019002008035号

